A Noncanonical mu-1A-Binding Motif in the N Terminus of HIV-1 Nef Determines Its Ability To Downregulate Major Histocompatibility Complex Class I in T Lymphocytes
Sayuki Iijima, Young-Jung Lee, Hirotaka Ode, Stefan Arold, Nobuyuki Kimura, Masaru Yokoyama, Hironori Sato, Yasuhito Tanaka, Klaus Strebel, and Hirofumi Akari
HIV-1は宿主免疫応答を特異的に制御することで、生体内において長期持続感染することが知られています。この機序として、HIV-1の調節 蛋白の一つであるNef蛋白が抗原提示分子であるMHCクラスI(MHC-I)の発現抑制が報告されていましたが、その詳細な分子機構はこれまで未解明で した。本研究では、MHC-I発現制御に必須である、Nef蛋白と輸送蛋白の一つであるAP-1複合体mu-1Aサブユニットによる特異的結合に関する分子構造学的なメカニズムを明らかにすることに成功しました。この成果は、Nef蛋白を持つ霊長類免疫不全ウイルスの宿主免疫制御機構を解明した重要な発見 であり、Journal of Virology誌2012年4月号に掲載されました。
掲載 website : http://jvi.asm.org/content/86/7/3944.abstract
Down-regulation of the major histocompatibility complex class-I (MHC-I) by HIV-1 Nef protein is indispensable for evasion of HIV-1 from protective immunity. Though it has been suggested that the N-terminal region of Nef contributes to the function by associating with a mu-1A subunit of adaptor protein-1, the structural basis of the interaction between Nef and mu-1A remains elusive. We found that a tripartite hydrophobic motif (Trp13/Val16/Met20) in the N-terminus of Nef was required for the MHC-I down-regulation. Importantly, the motif functioned as a non-canonical mu-1A-binding motif for the interaction with the tyrosine motif-binding site of the mu-1A subunit. Our findings will help understanding how HIV-1 evades the antiviral immune response by selectively redirecting the cellular protein trafficking system. Journal of Virology 86, 3944-3951, 2012

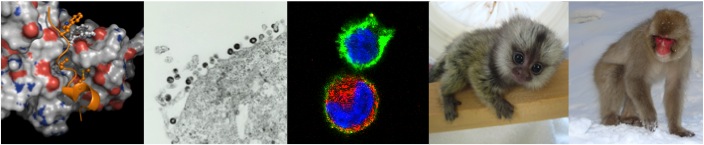
図1 Nef蛋白におけるTrp13およびNet20がmu-1Aとの結合に寄与することを示す免疫染色データ(Nef:青、MHC-1: 緑、mu-1A: 赤)。野生型Nef発現細胞(中段)では3分子が共局在(白色部分)するとともに、細胞表面におけるMHC-I発現レベルが顕著に低下している。一方、Trp13およびMet20の変異体(4,5段目)発現ではMHC-I発現レベルに影響を示していない。
Two amino acids at the N terminus of Nef contribute to binding with mu-1A. Cells were stained with Nef, MHC-I, and mu-1A antibodies and analyzed by confocal microscopy. Blue, Nef; green, MHC-I; red, mu-1A. Bars, 10 μm.